
许瑞明研究组与合作者共同揭示
人逆转座子LINE-1靶向整合基因组的重要机制
人类基因组中存在大量具有"跳跃"能力的逆转座子(retrotransposon)序列。在胚胎发育早期、免疫和神经系统等特定阶段和环境下,它们会被激活,发挥重要生理功能;在病毒感染、肿瘤发生和机体衰老等状态下,他们常常会持续异常活化,导致基因调控紊乱和基因组不稳定。
人体唯一具有自主转座活性的逆转座子是长散在元件1(LINE-1),是绝大多数逆转座子的迁移载体。其异常逆转座活性被认为与病毒基因整合、癌细胞和衰老细胞中的基因组紊乱等密切相关。LINE-1的逆转座过程由其编码的逆转录酶ORF2p通过一种被称为靶向启动逆转录(target-primed reverse transcription,TPRT)的机制完成。ORF2p含有两个核心功能域:核酸内切酶(EN)和逆转录酶(RT)。在细胞核内,EN首先靶向基因组DNA切割其中一条链形成缺口,切割的DNA 3'端胸腺嘧啶碱基(T)与RNA poly(A)尾端配对,启动RT逆转录程序合成cDNA链。第一条链合成完成后,ORF2p在DNA的第二链上重复该过程,最终实现LINE-1元件复制和整合到基因组中。然而,目前关于其靶向整合的分子机制仍不清楚。
2025年10月9日,中国科学院生物物理研究所许瑞明、朱冰和薛愿超课题组合作在《Science》发表题为"Mechanism of DNA targeting by human LINE-1"的研究论文,系统解析了LINE-1逆转座过程中的几个重要问题,包括RNA识别、DNA靶向切割和EN的活性调控,并阐明了复制偶联的逆转座机制。该研究纯化了处于活跃转座状态的ORF2p-内源核酸复合物。通过单颗粒冷冻电镜解析了高分辨率三维结构,揭示了ORF2p通过表面强电荷与基因组DNA相结合,并在RT逆转录活性中心通过多个氨基酸的变构调节进行cDNA合成的分子模型(图1)。
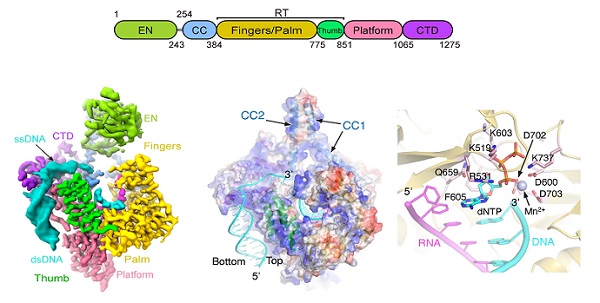
图1:LINE-1 ORF2p功能逆转座复合物的结构
该研究首次建立了高效的ORF2p体外DNA切割体系。发现ORF2p对特定分叉结构的DNA底物(尤其是DNA复制后滞链特有的flap结构)表现出很高的活性。同时,EN结构域的构象变化使ORF2p可以实现DNA双链的分步切割(图2A)。综合上述发现,该研究首次证明ORF2p是一个依赖于DNA底物结构的核酸内切酶,从而揭示了LINE-1整合与细胞复制周期相关的分子基础(图2A)。
该工作从结构和生化角度阐明了LINE-1逆转座过程中核酸底物的结合模式以及DNA结构介导的靶向切割机制。通过与细菌、昆虫等低等生物同源蛋白的跨物种结构比对,揭示了逆转座酶在进化过程中的保守和变异特征:其中逆转录活性高度保守,而DNA识别与切割方式存在显著差异。ORF2p与DNA骨架之间主要通过电荷相互作用结合,而非序列特征性识别,提示其在生理功能上的独特性。该研究刷新了对LINE-1逆转座机制的认知,也为基于逆转座调控的药物研发提供了新的理论依据。
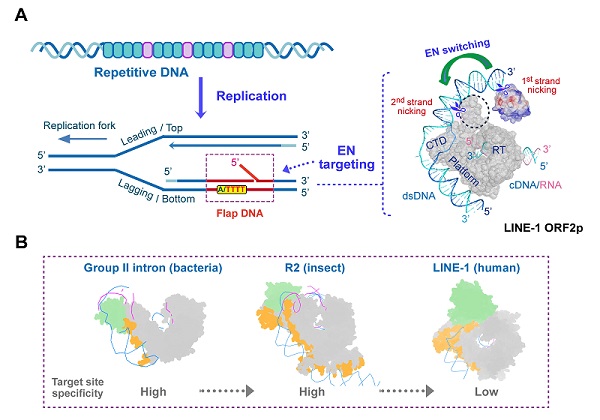
图2:LINE-1逆转座酶靶向切割DNA的分子机制。(A)LINE-1靶向识别复制过程中特殊分叉状DNA,并通过EN构象变化实现双链切割。(B)从低等到高等生物的逆转座酶结构对比图。
中国科学院生物物理研究所许瑞明研究员与金文星研究员为论文的共同通讯作者,金文星研究员、余聪博士(现为英国MRC-LMB博士后)、张彦副研究员为论文共同第一作者。工作的主要参与者还有许瑞明课题组的博士生夏天凡、技术员宋鸽,以及薛愿超课题组的曹唱唱副研究员、蔡兆奎副研究员。研究所电镜平台为数据采集提供了重要支持。该研究获得国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项的支持。
文章链接:https://www.science.org/doi/10.1126/science.adu3433
(供稿:许瑞明研究组)
附件下载: